高考(Q吧)化学复习须应对新变化新要求
近年来的化学高考中,实验的试题量逐年增加,尤其强调考查学生的创新精神、研究性学习的方法——
仔细分析琢磨上海 卷这几年的变化可以看出有以下几个特点:
卷这几年的变化可以看出有以下几个特点:
1.应用型的题目分值愈来愈大:试题与生产、生活、高科技等以实践为背景的联系愈来愈密切。举例分析如下:
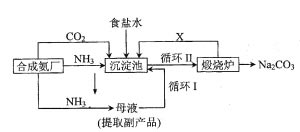
[例一]:(2005年高考题)我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程简要表示如下:
(1) 上述生产纯碱的方法称_______________,副产品的一种用途为___________。
(2)沉淀池中发生的化学反应方程式是_______________。
(3) 写出上述流程中X物质的分子式______________。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_____________。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_______。
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
2.注重获取信息和处理信息能力的题目已成为一种流行趋势,大家要注意考卷里给我们的信息其实都是有用的,其中有的题目的问题就是信息中已给出的,所以一定要读懂信息,理解信息,再根据信息解题。
3.考核你对图、表格、生产的流程线路等的观察、理解、分析能力:
举例分析如下:
[例二]:(2006年高考题)
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________。
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_____溶解、
氢氧化物Fe(OH)3 Al(OH)3 Mg(OH)2
开始沉淀pH 1.5 3.3 9.4 _________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________(填入物质的化学式),然后_________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______________(填写物质化学式)。
(5) 现设计一个实验,确定产品aMgCO3·bMg(OH)2·c H2O中a、b、c的值,
请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解
③____________________
④___________________________ ⑤MgO称量
(6)18.2g产品完全分解后,产生6.6g CO2和8.0 g MgO,由此可知,产品的化学式中:a=______;b=____ ;c=______
4.实验考核的要求愈来愈高。这几年实验的试题量在逐年增加,而且二期课改中非常强调的创新精神、研究性学习的方法等一定会在实验中有所体现,这也是最容易体现的。
复兴高级中学 高级教师 尚瑶
[责任编辑:moninfu]